Kaip ličio jonų akumuliatorius veikia elektromobilyje?
Turinys
Pažiūrėję kitame straipsnyje, kaip veikia visi automobiliai aprūpinti švino baterija, pažvelkime į elektromobilio ir ypač jo ličio akumuliatoriaus veikimo principą...

Princas
Kaip ir bet kokio tipo akumuliatoriaus, principas išlieka tas pats: būtent energiją (čia elektros energiją) generuoti cheminės ar net elektrinės reakcijos būdu, nes chemija visada artima elektrai. Tiesą sakant, patys atomai yra pagaminti iš elektros: tai yra elektronai, kurie skrieja aplink branduolį ir tam tikru būdu sudaro atomo „apvalkalą“ ar net jo „odelę“. Taip pat žinant, kad laisvieji elektronai yra plūduriuojantys odos dalelės, kurios praleidžia laiką judėdamos nuo vieno atomo prie kito (prie jo neprisijungdamos), tai galioja tik laidžioms medžiagoms (priklauso nuo elektronų sluoksnių skaičiaus ir elektronų skaičiaus viename). paskutinis sviedinys).
Tada per cheminę reakciją paimsime atomų „odos gabalėlį“ (taigi ir dalį jo elektros energijos), kad gautume elektros energiją.

pagrindai
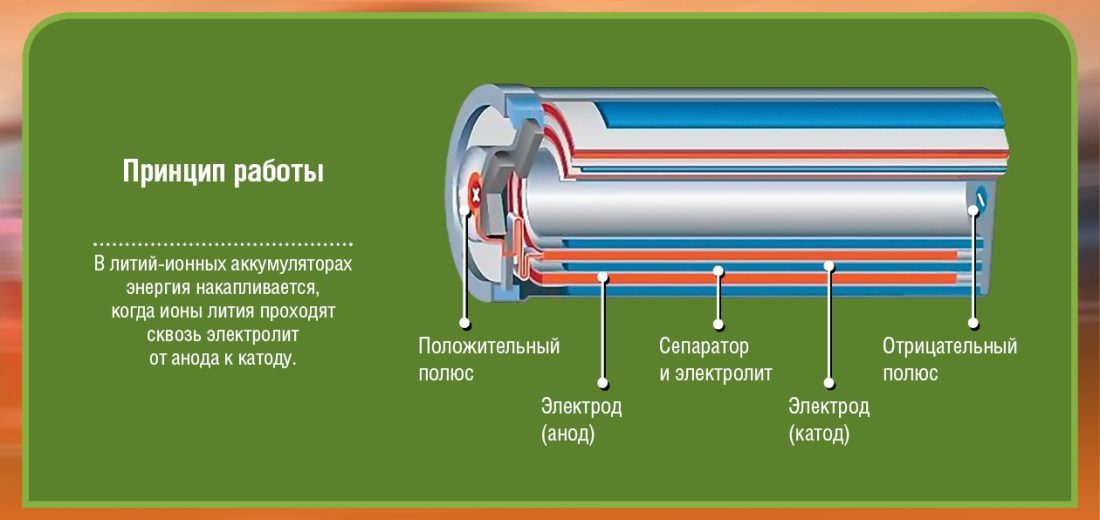
Visų pirma, yra du poliai (elektrodai), kuriuos mes vadiname katodas (+ gnybtas: ličio kobalto okside) ir anodas (terminalas -: anglis). Kiekvienas iš šių polių sudarytas iš medžiagos, kuri atmeta elektronus (-) arba traukia (+). Viskas užtvindyta elektrolitas kuri įgalins cheminę reakciją (medžiagos perkėlimą iš anodo į katodą), dėl kurios susidaro elektros energija. Tarp šių dviejų elektrodų (anodo ir katodo) įterpiamas barjeras, kad būtų išvengta trumpojo jungimo.
Atkreipkite dėmesį, kad baterija susideda iš kelių elementų, kurių kiekvieną sudaro tai, kas matoma diagramose. Jei, pavyzdžiui, sukaupsiu 2 2 voltų elementus, mano baterijos galia bus tik 4 voltai. Norėdami perkelti kelis šimtus kg sveriančią mašiną, įsivaizduokite, kiek elementų reikia...
Kas vyksta bandymų aikštelėje?
Dešinėje yra ličio atomai. Jie pavaizduoti išsamiai: geltona širdis žymi protonus, o žalia širdis – elektronus, apie kuriuos jie skrieja.
Kai baterija visiškai įkrauta, visi ličio atomai yra anodo (-) pusėje. Šiuos atomus sudaro branduolys (sudarytas iš kelių protonų), kurio teigiama elektrinė jėga yra 3, ir 3 elektronai, kurių neigiama elektrinė jėga yra 1 (iš viso 3, nes 3 X 1 = 3). . Todėl atomas yra stabilus, turintis 3 teigiamus ir 3 neigiamus (jis nei traukia, nei neatmeta elektronų).
Iš ličio pašaliname elektroną, kuris baigiasi tik dviem: tada jis pritraukiamas prie + ir praeina per pertvarą.
Kai užmezgu kontaktą tarp + ir – gnybtų (taigi, kai naudoju akumuliatorių), elektronai judės iš – gnybto į + gnybtą išilgai akumuliatoriaus išorinio elektros laido. Tačiau šie elektronai kilę iš ličio atomų „plauko“! Iš esmės iš 3 aplink skriejančių elektronų 1 numušamas, o atomui lieka tik 2. Staiga jo elektrinė jėga nebesusibalansuoja, o tai irgi sukelia cheminę reakciją. Taip pat atkreipkite dėmesį, kad ličio atomas tampa ličio jonas+ nes dabar yra teigiamas (3 – 2 = 1 / Branduolys vertas 3, o elektronai 2, nes praradome vieną. Sudėjus gaunamas 1, o ne 0 kaip anksčiau. Taigi jis nebėra neutralus).
Cheminė reakcija, atsirandanti dėl disbalanso (sulaužius elektronus, kad sukurtų srovę), turės poveikį ličio jonas+ prie katodo (+ gnybtas) per sienele skirta viskam izoliuoti. Galiausiai elektronai ir jonai + atsiduria + pusėje.
Kai reakcija baigiasi, baterija išsikrauna. Dabar yra pusiausvyra tarp + ir - gnybtų, todėl dabar nėra elektros energijos. Iš esmės principas yra sukelti depresiją cheminiu / elektriniu lygiu, kad būtų sukurta elektros srovė. Galime galvoti apie tai kaip apie upę, kuo ji labiau pasvirusi, tuo svarbesnis bus tekančio vandens intensyvumas. Kita vertus, jei upė plokščia, ji nebetekės, vadinasi, baterija išsikrovusi.
Įkrauti?
Įkrovimas susideda iš proceso apvertimo įpurškiant elektronų ir pašalinant daugiau juos įsiurbiant (šiek tiek primenant upės papildymą, kad ji vėl galėtų tekėti). Taigi viskas, kas yra akumuliatoriuje, atkuriama taip, kaip buvo prieš išsikrovimą.
Iš esmės iškraunant naudojame cheminę reakciją, o įkraunant grąžiname originalius daiktus (bet tam reikia energijos, taigi ir įkrovimo stotelės).
Nešioti?
Ličio akumuliatoriai susidėvi greičiau nei seni geri švino-rūgšties akumuliatoriai, kurie mūsų automobiliuose buvo naudojami šimtmečius. Elektrolitas linkęs irti, kaip ir elektrodai (anodas ir katodas), tačiau reikia atsižvelgti ir į tai, kad ant elektrodų susidaro nuosėdos, kurios sumažina jonų pernešimą iš vienos pusės į kitą... Specialūs prietaisai leidžia Jūs galite atkurti panaudotas baterijas, jas iškraunant specialiu būdu.
Galimų ciklų skaičius (iškrovimas + pilnas įkrovimas) yra apytiksliai 1000-1500, taigi su puse ciklo įkraunant nuo 50 iki 100%, o ne nuo 0 iki 100%. KARŠIMAS taip pat labai kenkia ličio jonų akumuliatoriams, kurie linkę įkaisti, kai iš jų gaunama per daug energijos.
Taip pat skaitykite: Kaip išsaugoti akumuliatorių mano elektromobilyje?
Variklio galia ir akumuliatorius...
Skirtingai nuo termovizoriaus, degalų bakas neturi įtakos galiai. Jei turite 400 AG variklį, tai 10 litrų bakas nesutrukdys gauti 400 AG net ir labai trumpam... Elektromobiliui tai visai ne tas pats! Jei akumuliatorius nepakankamai galingas, variklis negalės dirbti visu pajėgumu... Taip yra su kai kuriais modeliais, kur variklio niekada nepavyksta nustumti iki galo (nebent savininkas pamano ir prideda didelio kalibro akumuliatorių !).
Dabar išsiaiškinkime: kaip veikia ELEKTROS VARIKLIS
Visi komentarai ir reakcijos
paskutinis paskelbtas komentaras:
mao (Data: 2021 m., 03:03:15)
labai geras darbas
Il J. 1 reakcija į šį komentarą:
- Administratorius SVETAINĖS ADMINISTRATORIUS (2021-03-03 17:03:50): Šis komentaras dar geresnis 😉
(Patvirtinus jūsų įrašas bus matomas po komentaru)
Parašyk komentarą
Kaip vertinate gamintojų deklaruojamus vartojimo rodiklius?
