Nežinoma periodinės lentelės 3 dalis
Turinys
Paskutinis straipsnio epizodas apie periodinę lentelę, išskyrus mokyklinę (atitinka visos serijos pavadinimą). Šiandien apie dažniausiai nepastebėtas periodinės lentelės grupes, dirbtinius elementus, apie kuriuos praktiškai nieko nežinome, ir apie tai, kas mūsų laukia aštuntajame periode.
, dvi eilės, dažniausiai dedamos po lenta, mokykloje vertinamos panieka – mokytojas tik užsimins apie jų egzistavimą ir pereis prie kitų, „svarbesnių“ elementų. Visiškai netinkami funkcijai, kurią jie atlieka šiuolaikiniame pasaulyje. Uranas i Plutonas () yra branduolinės energijos pagrindas: patikimas šaltinis bet kokiomis klimato sąlygomis (skirtingai nei netradicinė energija), o tinkamai naudojama ji yra saugi ir nekenksminga aplinkai. Lantanidai šiuo metu yra strateginė žaliava, reikalinga daugeliui pažangių technologijų, pavyzdžiui, šiuolaikinė elektronika neegzistuotų be lantanidų. Tačiau net ir dabar abi grupes sunku nulaužti dėl periodiškumo dėsnio.
1 problema: Lantanidai
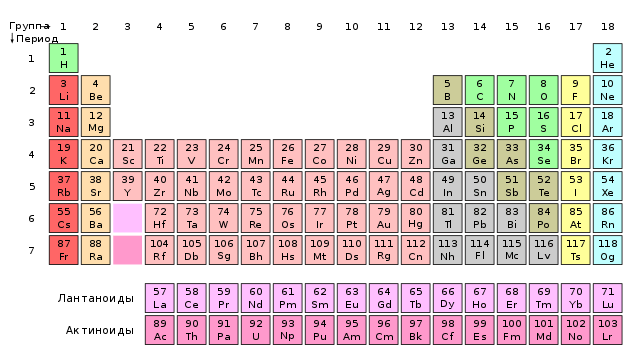
Mendelejevas jis žinojo tik kelis lantanidus ir be didelių sunkumų sugebėjo juos įtraukti į lentelę (1). Tačiau vėlesniais metais tokių metalų atradimai ginčijo patį periodiškumo dėsnį. Tam reikia, kad vienas po kito einantys elementai būtų gretimose grupėse ir turėtų skirtingą valentumą. Tuo tarpu lantanidai, turintys šiek tiek skirtingą atominę masę (tai reiškė, kad jie turėjo stovėti vienas po kito ištisinėje eilėje) visada turėjo III (kai kurie ir II ar IV) valentumą, tai yra, jie buvo toje pačioje grupėje. Apie tai buvo pateikta daug teorijų lantanidaiPavyzdžiui, skirtingose versijose jie visi buvo laikomi tuo pačiu elementu. Problema buvo išspręsta patalpinus lantanidus į vieną sistemos „dėžutę“, tačiau jų vietą periodinėje lentelėje paaiškino tik 20-30-ųjų kvantinė mechanika.
1. Ceris, labiausiai paplitęs lantanidas. Visi kiti lantanidai yra panašūs ir atrodo kaip aliuminis ()
Lantanidų problema aktuali ir šiandien. Tiesą sakant, nėra žinoma, su kuriuo elementu jie prasideda ir baigiasi. Pagal daugumą vadovėlių lantanas, nors ir davė pavadinimą visai šeimai, jam nepriklauso – jis 3 grupės skandalingaslantanidai yra metalai nuo cerio iki liutecio. Tačiau priešingos nuomonės rodo, kad paskutinis šeimos narys skenuoja daug geriau. melstis. Jo fizinės savybės ir susidarančių junginių cheminė prigimtis geriau atitinka kitų 3 grupės elementų savybes (taigi, lantanidai yra metalai nuo lantano iki iterbio). Chemikų diskusijos tęsiasi iki šiol, o knygų autoriai įvairiai pateikia šių elementų išsidėstymą (2).
2. Ilgiausia periodinės lentelės forma. Lantanidai ir aktinidai prasideda iškart po 2 grupės, o skandleriai yra liutecis ir laurenai.
2 problema: aktinidai
aktinidai, ty elementai nuo aktinio iki Lorenso, sudaro grupę, panašią į lantanidus, įtrauktus į kitą laikotarpį. Problema su aktinidais buvo ir išlieka tokia pati kaip ir su lantanidais. Mendelejevas žinojo tik du aktinidus ir be vargo surašė juos į lentelę (3). uolota viršukalnė su stipriausiu valentingumu IV grupė atiteko titano ir cirkonio grupei, o VI grupė su verte urano randama chromo, molibdeno ir volframo kompanijoje.
Atradimai XNUMX ir XNUMX amžių sandūroje sukrėtė sistemą: atsirado keliolika radioaktyvių elementų. Vieni jų turėjo vienodą masę, bet skirtingas savybes, o kiti turėjo tas pačias savybes – skirtingas mases. Šis faktas prieštaravo ankstesnėms žinioms, tačiau izotopų atradimas išaiškino kai kurias problemas. Paaiškėjo, kad dauguma elementų yra skirtingos masės atomų mišiniai (bet, žinoma, su tuo pačiu protonų skaičiumi branduolyje). Grįžtant prie aktinidų, du iš jų atsirado praėjusio amžiaus pradžioje. Aktinas iš karto pasirodė panašus į lantaną (jo radioaktyvumas buvo rastas lantanidų nuosėdose, nusodintose iš tirpalų, kuriuose yra aktinio), o protaktinas pateko į grupę, kurioje vanadis, niobis ir tantalas yra V-vertis elementas. Iki 40-ųjų pirmieji keturi aktinidai buvo ramiai išsidėstę grupėmis nuo 3 iki 6.
3. Dažniausi aktinidai: kairėje yra toris, padengtas dioksido sluoksniu, dešinėje - uranas ()
Problema iškilo įgyvendinant Manheteno projektą. Fizikai ir chemikai buvo tikri, kad gamino elementų, sunkesnių už uranątačiau jiems nepavyko aptikti jų buvimo cheminėmis priemonėmis. Pavyzdžiui: elementas 93 šalia urano nesielgė kaip 7 grupės narys. Tik Gleno Seaborgo, vėlesnio kelių transurano elementų atradėjo, pasiūlymas, kad elementai, prasidedantys aktiniumi, sudaro eilutes, panašias į lantanidus, išsprendė problemą (4 ). Naudojant sukurtus lantanidų atskyrimo metodus, daugiausia chromatografiją, vėlesniais metais buvo galima nustatyti dirbtinius elementus. Technologijos tobulumą ir eksperimentuotojų įgūdžius liudija faktas, kad kai kurių naujų elementų buvimas buvo atrastas tik su keliolika jų atomų! (penki).
Tačiau netikėkite, kad toris ar uranas staiga pakeitė savo savybes ir tapo į lantanidus panašiais trivalenčiais metalais. Jie vis dar turi daugiau bendro su titanidais ir chromu nei su kitais aktinidais. Panašiai ir su protaktinatais ir net kai kuriais transuranistais. Apie tam tikrą panašumą galime kalbėti tik antroje serijos pusėje. Tačiau negalima teigti, kad lantanidai ir aktinidai yra susijusios šeimos (tarsi jų vieta periodinėje lentelėje rodo jų vietą).
4. Glennas Seaborgas (1912–99) pateikia jo vardu pavadinto elemento simbolį.
5. Daugelio transuranistų gimtinė yra Lawrence'o Berkeley nacionalinėje laboratorijoje esantis ciklotronas (1939 m. rugpjūčio mėn.)
Jokių eksperimentinių duomenų
Netikslios žinios apie sunkiausių transuranidų savybes yra susijusios su nepakankamu medžiagos kiekiu tyrimams. Paskutinis elementas, pagamintas didžiuliu kiekiu miligramų, yra einšteinas, užimantis 99 vietą lentelėje. Žinoma, atliekami eksperimentai ir su kitais transuranidais, tačiau, pavyzdžiui, jų atveju tiriama būdinga nuosėdose kylanti spinduliuotė, o junginių kristalų susidarymo nepastebima.
Fizinės ir cheminės savybės Negalima tiesiog išmatuoti, o tik įvertinti remiantis netiesioginiais stebėjimais. Panaši problema kyla su dviem lengvesniais elementais: astatu (Nr. 85) i Prancūzų kalba (Nr. 87). Dėl trumpo jų gyvavimo laiko matomi dydžiai dar nebuvo gauti, todėl teorija turi užpildyti stebėjimų ir matavimų spragas. Kita vertus, metinė plutonio, kurio pėdsakai randami žemės plutoje, gamyba yra kelios tonos ir yra geriau suprantama nei daugelis lengvesnių patvariųjų elementų.
Dar didesnė problema yra su sunkiausiais elementais, kurių laikotarpis po aktinidų yra 7. Jų atveju tenka operuoti su atskirais atomais, kurių gyvavimo laikas skaičiuojamas sekundės dalimis. Nebeįmanoma nustatyti radioaktyvumo, esančio junginio, surišto su elementu, nuosėdose, o tik ištirti tam tikras fizines savybes (pavyzdžiui, nusėdimo ant tam tikro paviršiaus greitį) ir taip padaryti išvadas apie cheminį panašumą. Žinoma, padeda teorija, tiksliau skaičiavimai, paremti kvantine mechanika. Tačiau rezultatai nėra 100% patikimi, pavyzdžiui, pagal tam tikrą elektronų pasiskirstymą ant apvalkalų, cheminių savybių aprašymas dar toli. Kuo labiau tolstame nuo tiesioginių stebėjimų duomenų, tuo nepatikimesnė tampa „Mendelejevo metodo“ išvada (tai yra pagrįsta žinomų elementų savybėmis).
Chemikai ir fizikai bando nuspėti net sunkiausių, bet dar neaptiktų kito laikotarpio elementų savybes. 119 ir 120 elementai tikriausiai turės savybių, kurios nedaug skirsis nuo esančių virš francio ir radžio (1 ir 2 grupėse fizikinių ir cheminių savybių pokytis yra gana natūralus). 8 laikotarpiu, kaip ir lantanidai ir aktinidai, bus net 18 labai panašių g-bloko elementų savybių, kurių mokslininkai dar nenagrinėjo.
Skaičiavimai rodo, kad šiuo laikotarpiu egzistavo elementų, kurių valentingumas yra iki 12. Tikriausiai elementas 164 bus sistemoje, sunkesniems branduolio krūvis bus toks didelis, kad ant jų kris elektronai, o orbitos greitis viršytų šviesos greitis. Atlikti skaičiavimai neduoda vienareikšmių rezultatų, kai kurie periodinės lentelės ribas perkelia maždaug keliolika elementų.
Periodiškumo dėsnis šiukšliadėžėje?
Perskaitę straipsnį tikriausiai padarėte tokią išvadą daug išimčių iš mokykloje pateiktų taisyklių, tai suteikia teisę į klausimą atsakyti teigiamai. Bet neduok per greitai. Periodiškumo dėsnis jis suformuluotas labai apibendrintai (ypatybės kartojasi periodiškai), o tai ir privalumas, ir trūkumas. Iš tiesų privalumas, išanalizavus elemento padėtį dėsnio pagrindu sudarytoje lentelėje, galima padaryti išvadas apie jo fizikines ir chemines savybes. Trūkumas, nes išvados dažnai būna netikslios ar net klaidingos.
Periodiškumo dėsnis gerai veikia pagrindinėse grupėse (1, 2, 13-18), geriau jų viršutinėse dalyse nei apatinėse. 3 laikotarpis yra puikus pavyzdys: nuo natrio iki argono, valentingumas ir cheminės savybės keičiasi reguliariai, be jokių netikėtumų. Šoninėse grupėse (3-12) nukrypimai jau aiškiai matomi, tačiau apie lantanidų ir aktinidų problemas skaitykite aukščiau. Apskritai, kuo toliau nuo sistemos pradžios, tuo mažiau tiksliai laikomasi periodiškumo dėsnio.
Taigi į šiukšliadėžę? Cheminių elementų visata o jų kuriami santykiai yra tokia sudėtinga sistema, kad net geniali Mendelejevo idėja negali jos visiškai užfiksuoti. Įstatymą tikrai reikia taisyti ir patikslinti. Jei palygintume Mendelejevą su Niutonu (kadangi ir periodiškumo dėsnis, ir gravitacijos teorija suorganizavo ir paaiškino didelius mus supančio pasaulio gabalus), galime daryti išvadą, kad chemikai vis dar laukia savo Einšteino.
Taip pat žiūrėkite:

